Cryo-EM Avançado Expõe Estrutura Complexa de Duplicação de RNA Viral em Detalhes de “Mudança de Jogo”
Pela primeira vez, os pesquisadores do Morgridge Institute for Research criaram imagens de resolução quase atômica de uma proteína viral saudável significativa, responsável por replicar o genoma de RNA de um membro dos vírus de RNA de fita positiva, a classe massiva de infecções que inclui coronavírus, bem como muitos outros microrganismos.
Os resultados devem auxiliar no desenvolvimento de novos tipos de antivirais e fornecer percepções mecanicistas sobre o processo de vida do vírus.
“A capacidade de rápido avanço de imaginar essas estruturas vitais é uma mudança no jogo”, diz Paul Ahlquist, supervisor do John W. and Jeanne M. Rowe Facility for Virology Research no Morgridge Institute e professor de oncologia e também de virologia molecular no College de Wisconsin-Madison. Vários outros autores da pesquisa incluíram Nuruddin Unchwaniwala, Hong Zhan, Janice Pennington, Mark Horswill e Johan den Boon.
Eles estavam fazendo uso de uma estratégia avançada chamada tomografia de lente microscópica crioeletrônica (crio-EM); Ahlquist e sua equipe desenvolveram seu trabalho anterior, que inicialmente expôs a presença dessa complicada duplicação de RNA viral semelhante a uma coroa.
A nova pesquisa, lançada em 20 de julho no Processo da Academia Nacional de Ciências (PNAS), revela a facilidade de replicação da coroa em uma resolução significativamente melhorada de aproximadamente 8,5 angstroms, o que representa o espaçamento de alguns átomos.
“O Cryo-EM recentemente deu um salto quântico em suas capacidades”, afirma Ahlquist. “Nesta pesquisa, nossa equipe de estudo combinou vários avanços para melhorar significativamente a preparação da amostra, a compra de imagens, bem como o processamento de imagens, e para mapear a localização de nomes de domínio de proteínas específicos na instalação.”
As infecções de RNA de fita positiva resolvidas neste trabalho são as maiores das seis classes genéticas de doenças e consistem em muitos vírus vitais, como os vírus Zika, dengue e chikungunya, junto com coronavírus como o SARS-CoV-2, a fonte do presente pandemia de COVID-19.
Em cada vírus de RNA de fita positiva, a maioria da genética viral é dedicada a um único processo: reproduzir o genoma do RNA viral.
“Oferecendo este grande investimento de fontes, a duplicação do genoma do RNA viral é talvez um dos procedimentos mais cruciais na infecção e atualmente é um alvo importante para o controle de vírus”, diz Ahlquist.
Em uma célula contaminada, a replicação do RNA viral ocorre em camadas alteradas da membrana móvel, frequentemente associadas a esférulas, bolhas induzidas por vírus com dimensões de cerca de 50-100 nanômetros. Ahlquist e seu grupo revelaram anteriormente que em cada replicação do genoma complicada, uma duplicata do genoma ou cromossomo do RNA viral é protegida dentro da bolha esférica para operar como um modelo de duplicação. A instalação de duplicação duplica consistentemente este cromossomo de ARN viral de arquivo para produzir novos genomas lançados através de um pescoço membranoso na vesícula diretamente no citoplasma, onde são integrados como o transporte de novos vírions contagiosos.
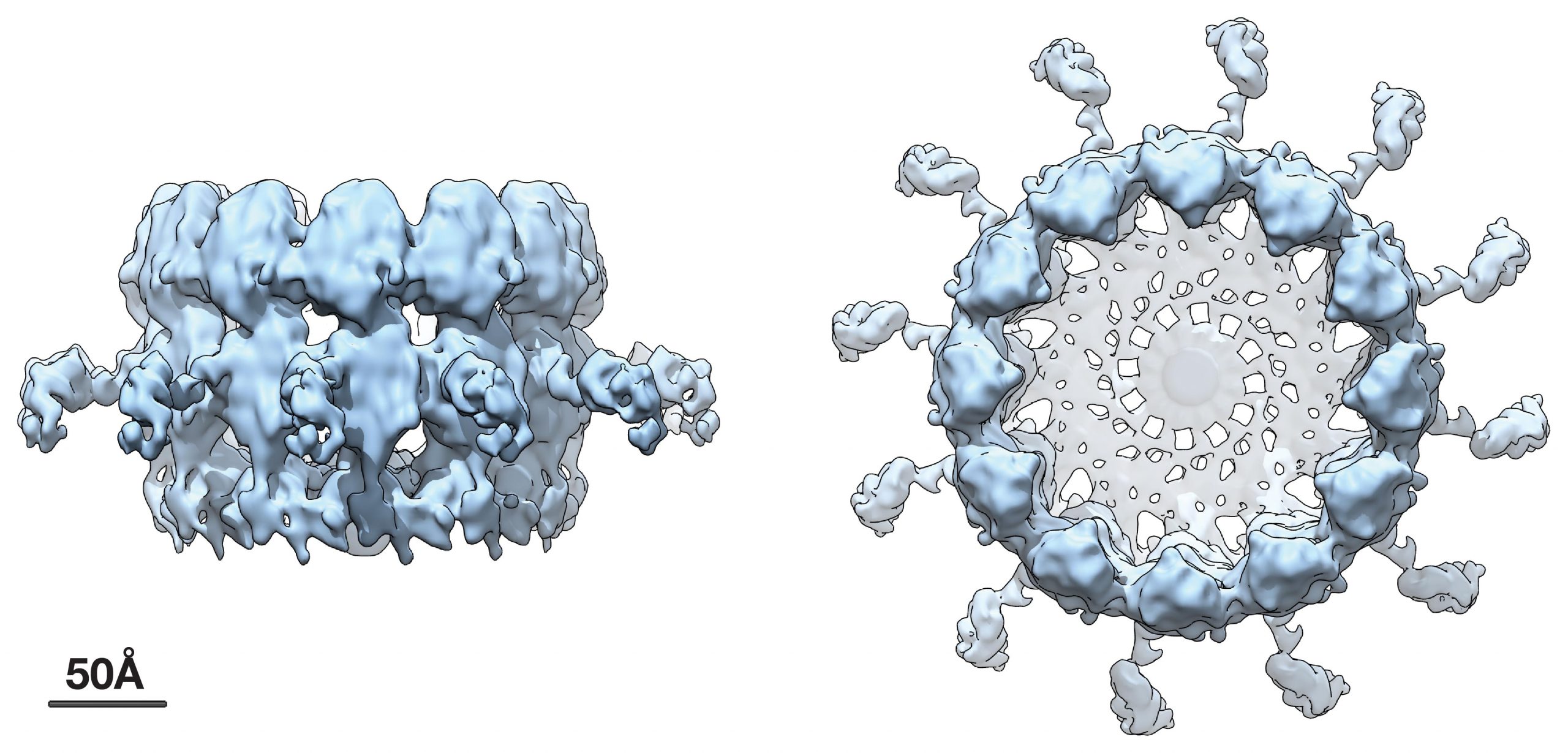
Este trabalho anterior mostrou que a proteína viral saudável crucial que gera as bolhas de duplicação e duplica o RNA viral vive em um anel marcante ou estrutura em coroa que fica no topo do lado citoplasmático do colo da esférula que se conecta ao citoplasma.
As novas imagens de crio-EM de resolução mais excelente e os resultados correspondentes mostram que a coroa compreende doze cópias da proteína saudável de replicação de RNA viral essencial, organizada como pautas em um barril. Além disso, as fotos revelaram comunicações em forma de zíper que agem como aros em um barril para se inscrever com segmentos próximos uns aos outros para criar a coroa em forma de anel. Essas interações de zíper correspondem bem às comunicações de multimerização que o grupo Ahlquist mapeou anteriormente nesta proteína.
A proteína saudável de duplicação de RNA viral que forma a coroa é uma proteína substancial, de múltiplos domínios e multifuncionais, com quase 1000 aminoácidos de dimensão. Esta proteína contém RNA polimerase e RNA cobrindo nomes de domínio – dois nomes de domínio enzimáticos que são salvos em vários vírus de RNA de fita positiva para a fabricação de novas cópias do genoma viral – além de outros nomes de domínio para multimerização, membranas de ligação e vários outros recursos .
O modo como esses nomes de domínio estão fisicamente organizados na estrutura da coroa é apenas uma das preocupações essenciais para a compreensão dos complicados recursos de replicação e também está entre as inúmeras motivações sólidas para especificar a estrutura da coroa de alta resolução.
Fazendo uso de um método que combinava uma etiqueta específica do local, geneticamente modificada com a marcação por partículas de ouro em nanoescala visíveis em crio-EM, os cientistas descobriram que a extremidade C-terminal da polimerase da proteína de duplicação de RNA viral é colocada no ápice do coroa, deixando o nome de domínio de cobertura do terminal N no final da estrutura para conectar com a membrana.
Esta posição apical da polimerase tem ramificações mecanísticas significativas para as etapas iniciais do procedimento de duplicação que recrutam o modelo de design de RNA viral inicial para o complicado e também cria o cisto de duplicação, além de para ação posterior em que o layout é duplicado para fazer novo os genomas das crianças devem ser empacotados em partículas de infecção transmissíveis. Esses resultados oferecem uma base sólida para experimentos adicionais para especificar a estrutura complexa de duplicação e função em graus ainda mais elevados.
“Queremos continuar a aprimorar a estrutura da coroa do complexo de replicação de RNA para fornecer refinamentos vitais adicionais no futuro”, diz Ahlquist. “Além disso, esperamos lidar com os indicadores crescentes de nosso trabalho de que as mudanças conformacionais nessas proteínas saudáveis são vitais para suas funções múltiplas.”
“Esses avanços revelarão ao realçar as informações de como esses complicados são montados e operados, e também como poderiam ser atacados de maneira ideal”, ele inclui. “Essas percepções precisam fornecer a base para dispositivos antivirais novos e mais poderosos.”
Referência: “Estrutura crio-EM de subdomínio da proteína de replicação nodaviral A coroa complexa fornece insights mecanísticos sobre a replicação do genoma do RNA” por Nuruddin Unchwaniwala, Hong Zhan, Janice Pennington, Mark Horswill, Johan A. den Boon e Paul Ahlquist, 20 de julho de 2020, Proceedings da Academia Nacional de Ciências .
DOI: 10.1073 / pnas.2006165117