Rastreando o Caminho de Sinalização de Óxido Nítrico
Tanto o óxido nítrico (NO) quanto o sulfeto de hidrogénio (H2S) funcionam como moléculas de sinalização gasosa com efeitos fisiológicos comparáveis. Muitas das preocupações vitais relativas à interação entre esses dois gasotransmissores dependem da sua reatividade química e da existência fugaz de HSNO, um produto essencial da reação entre eles. Conforme relatado na revista Angewandte Chemie, um grupo de cientistas estabilizou, isolou e identificou 2 das espécies conectadas a essas vias de sinalização com ligação ao complexo de zinco.
NO é a molécula sinalizadora central em biologia que controla muitas funções fisiológicas, incluindo dilatação vascular, impulsos nervosos e proteção celular. Notavelmente, o H2S mostra efeitos semelhantes, relaxando as células musculares lisas envolvidas na vasodilatação. HSNO pode, portanto, desempenhar um papel essencial na sobreposição desses caminhos de sinalização. No entanto, esta espécie reativa é tão instável que a sua bioquímica e caminhos de reação distintos são complicados de definir. O HSNO passa convenientemente pelas membranas celulares e pode nitrosilar proteínas, movendo o seu grupo nitrosila (-N = O) para outros resíduos, principalmente a cisteína, que representa uma importante ação em vários mecanismos regulatórios celulares. Em pH biológico, o HSNO provavelmente existe como o ânion de tionitrito SNO– que é instável em relação à conversão para o ânion de pertionitrito SSNO–.
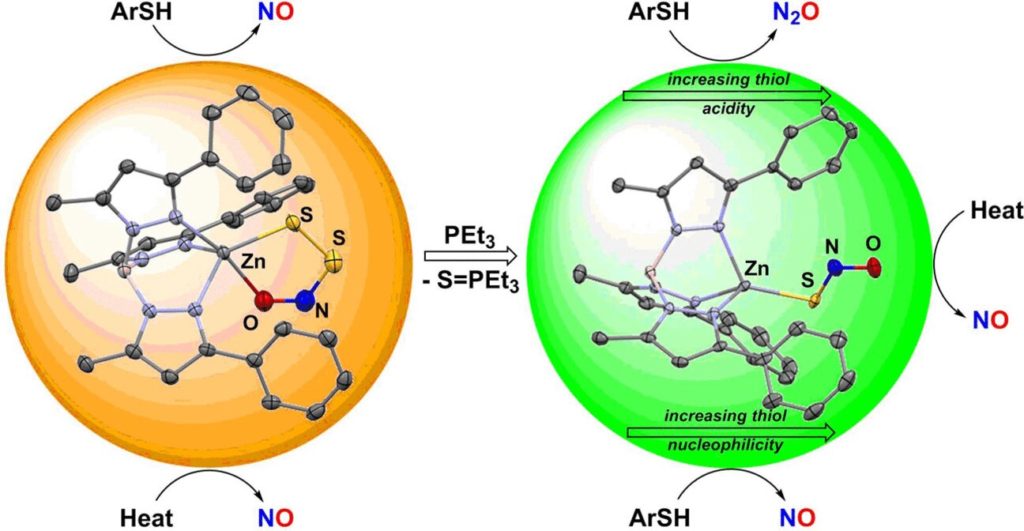
Valiallah Hosseininasab, um estudante graduado da equipa liderada por Timothy H. Warren no Georgetown College (Washington, DC, EUA), estabilizou os aniões SNO− e SSNO− por meio da ligação a um complexo de zinco único influenciado por um ambiente típico de zinco em biologia. Do ponto de vista fisiológico, o zinco é essencial para o metal associado a muitos processos, incluindo a regulação do pH do sangue por meio da enzima anidrase carbônica. Além disso, as moléculas envolvidas na sinalização do óxido nítrico, como H2S e S-nitrosotióis (moléculas com uma equipe -SN = O), prontamente reagem com ligações de enxofre de zinco que criam unidades estruturais vitais cujo ajuste nas proteínas causa mudança funcional.
A equipa de Georgetown mostrou que os complexos de zinco que consistem nos aniões SNO− e SSNO− podem ser isolados e definidos. O exame dos seus padrões de reatividade revelou diferenças fascinantes nas suas reações com tióis (substâncias com um grupo sulfeto, -SH), antioxidantes onipresentes que ajudam a proteger as células de danos. Enquanto as reações com pertionitrito produzem NO, o tionitrito forma óxido de dinitrogénio (gás hilariante) N2O ou S-nitrosotióis, reservatórios de NO prontos. Esses resultados implicam que as menores diferenças ao longo dos caminhos de sinalização fisiológica podem causar vários sinais de saída que, em última análise, resultam da interação entre NO e H2S.
Originalmente publicado por: phys.org
Referência: Valiallah Hosseininasab et al, Thionitrite and Perthionitrite in NO Signaling at Zinc, Angewandte Chemie International Edition (2021). DOI: 10.1002 / anie.202104906